Enzim merupakan senyawa protein yang berfungsi sebagai katalisator reaksi-reaksi kimia yang terjadi dalam sistem biologi (makhluk hidup). Oleh karena merupakan katalisator dalam sistem biologi, enzim sering disebut biokatalisator. Katalisator adalah suatu zat yang mempercepat reaksi kimia, tetapi tidak mengubah kesetimbangan reaksi atau tidak mempengaruhi hasil akhir reaksi. Zat itu sendiri (enzim) tidak ikut dalam reaksi sehingga bentuknya tetap atau tidak berubah.
Tanpa adanya enzim, reaksi-reaksi kimia dalam tubuh akan berjalan lambat. Apakah sebenarnya enzim itu dan bagaimanakah cara kerjanya?
Apa saja Komponen
Enzim ?
Enzim (biokatalisator)
adalah senyawa protein sederhana maupun protein kompleks yang bertindak sebagai
katalisator spesifik. Enzim yang tersusun dari protein sederhana jika diuraikan
hanya tersusun atas asam amino saja, misalnya pepsin, tripsin, dan kemotripsin. Sementara itu, enzim yang
berupa protein kompleks bila diuraikan tersusun atas asam amino dan komponen
lain.
Enzim lengkap atau
sering disebut holoenzim, terdiri
atas komponen protein dan nonprotein. Komponen protein yang
menyusun enzim disebut apoenzim.
Komponen ini mudah mengalami denaturasi,
misalnya oleh pemanasan dengan suhu tinggi. Adapun penyusun enzim yang berupa
komponen nonprotein dapat berupa komponen organik dan anorganik. Komponen
organik yang terikat kuat oleh protein enzim disebut gugus prostetik, sedangkan
komponen organik yang terikat lemah disebut koenzim. Beberapa contoh koenzim antara lain:
vitamin (vitamin B1, B2,
B6, niasin, dan biotin), NAD (nikotinamida adenin dinukleotida), dan koenzim A
(turunan asam pentotenat). Komponen anorganik yang terikat lemah pada protein
enzim disebut kofaktor atau aktivator, misalnya beberapa ion logam seperti Zn2+,
Cu2+, Mn2+, Mg2+, K+, Fe2+, dan Na+.
Bagaimana Cara Kerja
Enzim ?
Salah satu ciri khas enzim yaitu bekerja secara spesifik.
Artinya, enzim hanya dapat bekerja pada substrat tertentu. Bagaimana cara kerja
enzim? Beberapa teori berikut menjelaskan tentang cara kerja enzim.
Lock and Key Theory (Teori Gembok dan Kunci)
Teori ini dikemukakan oleh Fischer (1898). Enzim diumpamakan
sebagai gembok yang mempunyai bagian kecil dan dapat mengikat substrat. Bagian
enzim yang dapat berikatan dengan substrat disebut sisi aktif. Substrat
diumpamakan kunci yang dapat berikatan dengan sisi aktif enzim. Perhatikan
Gambar berikut.
Selain sisi aktif, pada enzim juga ditemukan adanya sisi
alosterik. Sisi alosterik dapat diibaratkan sebagai sakelar yang dapat
menyebabkan kerja enzim meningkat ataupun menurun. Apabila sisi alosterik
berikatan dengan penghambat (inhibitor), konfigurasi enzim akan berubah
sehingga aktivitasnya berkurang. Namun, jika sisi alosterik ini berikatan
dengan aktivator (zat penggiat) maka enzim menjadi aktif kembali.
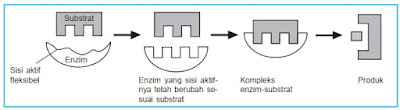
Induced Fit Theory (Teori Ketepatan Induksi)
Sisi aktif enzim bersifat fleksibel sehingga dapat berubah
bentuk menyesuaikan bentuk substrat. Perhatikan Gambar dan diskusikan dengan
teman sebangku.
Diskusi
:
Pada umumnya sebuah enzim hanya mampu menjadi katalisator pada sebuah atau beberapa reaksi kimia, dengan catatan substrat itu mempunyai struktur umum sama, sesuai dengan Teori Gembok dan Kunci. Nah, sekarang perhatikan gambar berikut
Diskusikan dengan kelompok Anda di antara kelima substrat tersebut. Manakah yang dapat bereaksi dengan enzim? Jelaskan alasannya dan presentasikan di depan kelas.Bagaimana Penghambatan
Aktivitas Enzim terjadi ?
Telah dijelaskan bahwa mekanisme kerja enzim dalam suatu reaksi
kimia dilakukan melalui pembentukan kompleks enzim substrat. Adakalanya reaksi
kimia yang dikatalisir enzim mengalami gangguan, yaitu jika enzim itu sendiri
mengalami penghambatan. Molekul atau ion yang menghambat kerja enzim disebut inhibitor. Terdapat tiga jenis inhibitor,
yaitu inhibitor reversibel, inhibitor
tidak reversibel, dan inhibitor
alosterik.
Inhibitor Reversibel
Inhibitor reversibel meliputi tiga jenis hambatan berikut.
1.Inhibitor
kompetitif
(hambatan bersaing)
Pada penghambatan ini zat-zat penghambat mempunyai struktur mirip dengan struktur substrat. Dengan demikian, zat penghambat dengan substrat saling berebut (bersaing) untuk bergabung dengan sisi aktif enzim
2.Inhibitor
nonkompetitif
(hambatan tidak bersaing)
Penghambatan ini dipicu oleh terikatnya zat penghambat pada sisi alosterik sehingga sisi aktif enzim berubah. Akibatnya, substrat tidak dapat berikatan dengan enzim untuk membentuk kompleks enzim-substrat
3.Inhibitor umpan
balik
Hasil akhir (produk) suatu reaksi dapat menghambat bekerjanya
enzim. Akibatnya, reaksi kimia akan berjalan lambat. Apabila produk
disingkirkan, reaksi akan berjalan lagi.
Inhibitor Tidak
Reversibel
Hambatan ini terjadi karena inhibitor bereaksi tidak reversibel
dengan bagian tertentu pada enzim sehingga mengakibatkan bentuk enzim berubah.
Perubahan bentuk enzim ini mengakibatkan berkurangnya aktivitas katalitik enzim
tersebut. Hambatan tidak reversibel umumnya disebabkan oleh terjadinya proses destruksi atau modifikasi sebuah gugus enzim atau lebih yang terdapat pada molekul
enzim.
Inhibitor Alosterik
Pada penghambatan alosterik, molekul zat penghambat tidak
berikatan pada sisi aktif enzim, melainkan berikatan pada sisi alosterik.
Akibat penghambatan ini sisi aktif enzim menjadi tidak aktif karena telah
mengalami perubahan bentuk.
Apa saja yang
merupakan Sifat-Sifat Enzim ?
Secara ringkas
sifat-sifat enzim dijelaskan sebagai berikut.
a. Enzim merupakan
biokatalisator. Enzim dalam jumlah sedikit saja dapat mempercepat reaksi
beribu-ribu kali lipat, tetapi ia sendiri tidak ikut bereaksi.
b. Enzim bekerja
secara spesifik. Enzim tidak dapat bekerja pada semua substrat, tetapi hanya
bekerja pada substrat tertentu saja. Misalnya, enzim katalase hanya mampu
menghidrolisis H2O2 menjadi H2O dan O2.
c. Enzim berupa
koloid. Enzim merupakan suatu protein sehingga dalam larutan enzim membentuk
suatu koloid. Hal ini menambah luas bidang permukaan enzim sehingga
aktivitasnya lebih besar. d. Enzim dapat bereaksi dengan substrat asam maupun
basa. Sisi aktif enzim mempunyai gugus R residu asam amino spesifik yang
merupakan pemberi atau penerima protein yang sesuai.
e. Enzim bersifat
termolabil. Aktivitas enzim dipengaruhi oleh suhu. Jika suhu rendah, kerja
enzim akan lambat. Semakin tinggi suhu, reaksi kimia yang dipengaruhi enzim
semakin cepat, tetapi jika suhu terlalu tinggi, enzim akan mengalami
denaturasi.
f. Kerja enzim bersifat bolak-balik (reversibel). Enzim tidak dapat menentukan arah reaksi, tetapi hanya mempercepat laju reaksi mencapai kesetimbangan. Misalnya enzim lipase dapat mengubah lemak menjadi asam lemak dan gliserol. Sebaliknya, lipase juga mampu menyatukan gliserol dan asam lemak menjadi lemak. Enzim tidak hanya menguraikan molekul kompleks, tetapi juga dapat membentuk molekul kompleks dari molekul-molekul sederhana penyusunnya (reaksi bolak-balik). Perhatikanlah skema pada Gambar berikut agar Anda dapat memahami sifat enzim dengan lebih jelas.
Seperti halnya reaksi kimia, reaksi enzimatis juga dipengaruhi oleh faktor-faktor tertentu, contoh enzim laktase. Enzim ini terdapat pada organ hati. Laktase berfungsi mengubah hidrogen peroksida (H2O2) menjadi H2O dan O2
Apa faktor-faktor
yang mempengaruhi kerja enzim ?
a. Suhu (Temperatur)
Aktivitas enzim dipengaruhi oleh
suhu. Enzim pada suhu 0°C tidak aktif, akan tetapi juga tidak rusak. Jika suhu
dinaikkan sampai batas optimum, aktivitas enzim semakin meningkat. Jika suhu
melebihi batas optimum, dapat menyebabkan denaturasi protein yang berarti enzim
telah rusak. Suhu optimum untuk aktivitas enzim pada manusia dan hewan berdarah
panas ± 37°C, sedangkan pada hewan berdarah dingin ± 25°C. Hubungan antara suhu
dengan kecepatan reaksi (enzimatis) dijelaskan dalam Gambar berikut.
b. pH (Derajat
Keasaman)
Enzim mempunyai pH optimum yang
dapat bersifat asam maupun basa. Sebagian besar enzim pada manusia mempunyai pH
optimum antara 6–8, misalnya enzim tripsin yang mendegradasi protein. Namun,
ada beberapa enzim yang aktif pada kondisi asam, misalnya enzim pepsin.
Perubahan pH dapat mempengaruhi efektivitas sisi aktif enzim dalam membentuk
kompleks enzim-substrat. Selain itu, perubahan pH dapat menyebabkan terjadinya
proses denaturasi sehingga menurunkan aktivitas enzim. Grafik hubungan antara
pH dengan kecepatan reaksi dapat dilihat pada Gambar berikut.
c. Konsentrasi Enzim
Pada umumnya konsentrasi enzim
berbanding lurus dengan kecepatan reaksi. Hal ini berarti penambahan
konsentrasi enzim mengakibatkan kecepatan reaksi meningkat hingga dicapai
kecepatan konstan. Kecepatan konstan tercapai apabila semua substrat sudah
terikat oleh enzim. Perhatikan grafik pada Gambar berikut.
d. Zat-zat Penggiat
(Aktivator)
Terdapat zat kimia tertentu yang
dapat meningkatkan aktivitas enzim. Misalnya, garam-garam dari logam alkali
dalam kondisi encer (2%–5%) dapat memacu kerja enzim. Demikian pula dengan ion
logam Co, Mg, Ni, Mn, dan Cl. Akan tetapi, mekanisme kerja zat penggiat ini
belum diketahui secara pasti.
e. Zat-Zat Penghambat
(Inhibitor)
Beberapa zat kimia dapat menghambat
aktivitas enzim, misalnya garam-garam yang mengandung merkuri (Hg) dan sianida.
Dengan adanya zat penghambat ini, enzim tidak dapat berikatan dengan substrat
sehingga tidak dapat menghasilkan suatu produk.
Disalin dari : Sembiring L,Sudjino,2009,Biologi Kelas XII untuk SMA/MA,Jakarta,Pusat Perbukuan Departemen Pendidikan Nasional.











0 Komentar